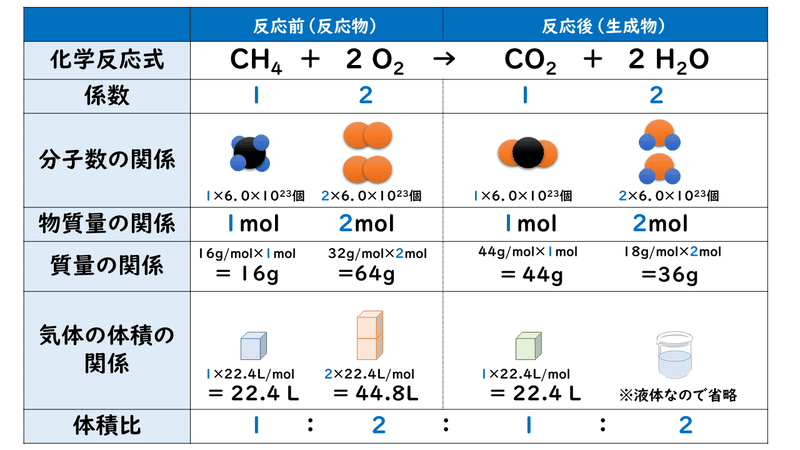
これを基に,エタノール15molの完全燃焼における気体の体積〔L〕の関係を確認します。 C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O エタノールは標準状態で液体なので,省略; モル濃度 溶質 溶液 モ ル 濃 度 (m o l / L) = 溶 質 (m o l) 溶 液 (L) = (m o l) 40 (L) ≒ 050 (m o l / L) 体積は、どの気体も標準状態ならば1molが224Lなので 18molは4032L、 分子数はどんな物質でも1molで602×10^23(10の23乗)個なので 18molあると 18×602×10^23=108×10^25個となります ②化学式CO2の二酸化炭素について体積が224Lの時の分子量、質量、分子数を求めよ。
5 2 化学反応の量的関係 1 おのれー Note
体積求め方 化学
体積求め方 化学-とすると、同温・同体積のとき、 \(\hspace{10pt} P\mathrm{_A}P\mathrm{_B}=n\mathrm{_A}n\mathrm{_B}\) となります。 また、気体の体積も物質量に比例しますので、 混合気体の成分の体積比も混合気体中の物質量の比になります。 センター試験 化学の問題です。 写真の解法として、スマートなやり方を教えて下さい。 解説に乗っているのは ①電気分解の式を作り、電子何molで気体が何mol発生したかを求める ②965×1/Fでmo lを求め、発生したmolの割合をかけ、発生物のgをかける。



物質量と気体の体積 化学基礎 高校化学net参考書
ファントホッフの法則の式(πV=nRT)に問題文で与えられている数値を代入すると πV = nRT ↔ π = nRT V = 333 111 × 3 × × 103 × (27 273) 02 ≒ 11 × 106(Pa) nの値(333/111)に3を掛けているのは、塩化カルシウムが電解質であり、次のように電離して1molのCaCl 2 から3molのイオンが生成するためである。 CaCl2 → Ca2 2Cl − 化学 10リットルの体積に水素と空気を入れて0℃1atmしたあと水素ガスを完全燃焼したところ酸素が完全に消費された(窒素:酸素=4:1)(体積比) 水素の体積を求める方法を教えて・モル体積は常に正 ⇔ 部分モル体積は正であるとは限らない (例) 水溶液中のMgSO 4 の極限部分モル体積: -14 cm3 mol1 (濃度が 0 の極限における部分モル体積) 1 mol のMgSO 4 を大量の水に加えると体積が14 cm3減少する
というもので圧力 \(P\) 体積 \(V\) とすると \(\color{red}{PV=k}\) と表されるものです。 シャルルの法則は一定圧力の元では、 「一定量の気体の体積は絶対温度に比例する」 というもので体積 \(V\) 絶対温度 \(T\) とすると \(\color{red}{V=kT}\) と表されます。1m=100cmですから、1m 3 =100 3 cm 3 =10 6 cm 3 です。 また、1kg=10 3 gですから、00Kg=2×10 6 gです。 したがって、この物質の密度は 2×10 6 g÷10 6 cm 3 =g/cm 3 となります。 1ℓ=1000cm 3 ですから、10ℓ=10 4 gです。 したがって、この物質10ℓの質量は、×10 4 gとなります。 ちなみに、化学ではg/cm 3 やg/mlがよく用いられます。 モル体積=分子1個当たりの体積×602×10 23 個 となるから モル質量÷モル体積 =(分子1個当たりの質量×602×10 23 個)÷(分子1個当たりの体積×602×10 23 個) =分子1個当たりの質量÷分子1個当たりの体積 となり、モル質量÷モル体積は密度になることがわかる。 高校化学を3ヶ月で習得する必殺勉強法(ある程度化学がわかる人向け。 化学重要問題集を使い倒す
化学式の係数比から体積の比の式を作ります。 係数比は N 2 :H 2 :NH 3 =1 : 3 : 2 なので これを解くと、 v=168ℓ、a=425 mol となります。化学講座 第48回:浸透圧 きゅうりを濃い漬物液につけてしばらく置いておくと、水分が抜けてしんなりとしますね。 これは濃度の低い溶液から高い溶液に向かって溶媒が移動するという性質によって起こる現象です。 これを二つのピストンと、溶媒分子円柱の体積を求める公式は、 V = Sh = πr^2 h で表されます。このページでは、例題と共に、円柱の体積を計算する方法を説明しています。また、斜円柱の体積の求め方も説明しています。



丸パイプ パイプの体積と重量計算方法 鉄 ステンンレス 銅の場合




モル計算 単位を駆使 物質量molが絡む問題の解法 原子量 体積 アボガドロ数など 化学のグルメ
溶質の物質量mol / 溶液の体積L で計算できるので、 求めるモル濃度は 05mol / 2L = 025mol/L・・・(答) となります。 モル濃度は、溶質の物質量mol / 溶液の体積Lで計算できるので単位はmol/Lとなります。 体積Lの容器に0molの水素H 2 と030molの窒素N 2 を入れて27℃にした。 このときの混合気体の全圧、またH 2 とN 2 の分圧をそれぞれ求めよ。 (気体定数R=×10 3 とする) 気体の体積を求める時の数字は、224(l)です。 molから求めるので、使われるのはかけ算になります。 つまり、 224×5=112 なので、 112L が正解です。



基礎化学3 溶液




例題12の 2 の求め方 Clear
水素H 2 、アセチレンC 2 H 2 、一酸化炭素COの混合気体Aがある。 A50mLに酸素60mLを加え、これらを完全燃焼させたところ体積は375mLになった。 燃焼後の気体を水酸化ナトリウム水溶液に通すと体積は125mLになった。 サイエンス 化学 nor******** nor******** さん 13/8/28 1913 1 1 回答 液体または溶液の体積の求め方を知りたいです! また ①250gの水に30gの食塩または重曹を溶かした時の体積 ②250gの水に砂糖を30g溶液体のかした時と60g溶かした時、体積に違いはありますか?化学講座 第37回:分圧の法則と2気体の混合 理想気体は相互作用を及ぼさないのでした。 ということは、二種類の気体が混合されている気体を考えるとき、一種類ずつ別々に気体の圧力を求める事ができるのです。 お互い干渉しないのだから、別々に求め




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月




物質量molの超解説 理系ラボ
まず、 気体1molあたりの体積は224L です。 これを利用して、比例式を立ててみましょう。 1mol224L= 5molxL x=112 よって、答えは、 112L となります。原子の体積は4/3πr3 で与えられるので,単位格子中の原子に占められる全体積は2 × 4/3πr3. 充填率を求めるためには,単位格子の長さa を原子の半径r で表す必要がある.そのためには,単位格子中の 2個の直角三角形を用いる.求める単位格子の体積を \(x\) とおいて公式にあてはめるだけですね。 \( \displaystyle \frac{104\times x}{108}=\displaystyle \frac{4}{602\times 10^{23}}\) 計算して求めると \(x\,≒\,\mathrm{690\times 10^{23}(cm^3)}\) ていねいに処理すると、 分母をなくして




物質量molの超解説 理系ラボ




浮力の公式と計算方法まとめ 計算問題 体積の原理からの求め方 理系ラボ
密度とは、溶液全体の質量gを溶液全体の体積Lで割ったものです。 以下公式です。 $$密度g/cm^3 = \frac{溶液全体の質量g}{溶液全体の体積cm^3}$$ 質量モル濃度とは おまけです。質量モル濃度とは、溶質の物質量molを溶 媒 の質量kgで割ったものです。 標準状態(0℃、1013×10 5 Pa)における気体1molあたりの体積(モル体積)V m は224L/molである。 したがって、気体の物質量が1molのとき、定数kの値は次のようになる。 k = PVm T = 1013 × 105(Pa) × 224(L / mol) 273(K) ≒ 1 × 103(Pa ・ L K ・ mol) こういう疑いを持ったときは、密度を調べてみればいいんだ。 密度の出し方の計算公式に当てはめてみると、 密度 g/cm³ = 質量 ÷体積 = 1000÷111 = 9001 だいたい密度が9 g/cm³ってことがわかった。 このとき、 「この延べ棒はぜんぶ金でできてない




単位格子中の原子の質量の求め方がなぜ線を引いたところのようになるかわかりません 教え Clear




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ
化学Ⅱ 元素の周期について 価電子数の求め方がわかりません。 ⇩問題⇩ 次の元素群の固有名を記入し、価電子数の数を答えなさい。 1 F,Cl,Br,I ちなみに「I」はヨウ素 2 Li,Na,K 3 C a,Sr,Ba 4 He,Ne,Ar 答えは 1 ハロゲン 価電子数7 2 アルカリ金属 価電子数1 314年度看護学部「化学」(担当:野島 高彦) (11) 気体の体積を計算する問題 二酸化炭素CO 2の660 gが,1013 hPa,27 °Cで占める体積は何m3か,また,何Lか. CO 2のモル質量は440 g mol–1,気体定数は1 Pa m3 K–1 mol–1,0 °C = 273 Kとして計 算せよ. 温度は27 °C = (273 27) K = 300 K物質量と気体の体積の関係 気体の密度 アボガドロの法則とは物質の種類に関係なく、 物質量(モル)と分子数や気体の体積が比例するという法則です。 物質量に比例するので原子や分子の粒子数に比例するということにもなります。 アボガドロの法則は密度などにも関係するので化学を学ぶ上で非常に大切な法則です。 固体や液体の量は、粒子の数で基準を




高校化学 高校化学 50枚 0度で2atmの窒素が水に接しているとき Okwave




高校化学基礎 モル体積と気体 練習編 映像授業のtry It トライイット
三辺の長さが a, b, h の 直方体(ちょくほうたい) 三辺の長さが a,b,h a, b, h の直方体の体積 V V は、次の式で求められます。 直方体 ( ちょくほうたい ) の体積 V = abh V = a b h 体積 = たて × 横 × 高さ溶液の体積が欲しいところですがここでは比重から出す必要があります。 \displaystyle \color {red} {d=\frac {w} {v}} なので溶液の体積は \displaystyle \color {red} {v=\frac {w} {d}} とすることができます。 溶液の体積は \displaystyle \frac {} {115} と表すことができますので公式にあてます。 \displaystyle \frac {40} {98}=x\times \displaystyle \frac {\,\displaystyle \frac {} {115}\,} 化学基礎 含有率の求め方がよく分かりません。 塩化アンモニウムNH4Clと塩化アンモニウムNAClの混合物150g 水に溶かした後、水酸化ナトリウムを加えてアルカリ性にして加熱した。このとき 発生したアンモニウムを 00mol/Lの希硫酸250mLに全て吸収させた。



高校化学基礎まとめ 金属結晶の充填率の求め方 Mm参考書




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン
比重の求め方教えてください 6 密度の程度の言い方がわかりません 7 セメント1袋25kgを25Lの水と混 8 アメダスの降水量のmmをmlに直 9 至急お願いします! 10 5立方メートルは何kl? 11 質量と体積の違いを教えてくだ 12 水の体積の変化について 13




エタノール アルコール が気体に変わると体積は何倍になるのか 体積比 体積膨張率 の計算 白丸くん



1




5 2 化学反応の量的関係 1 おのれー Note



中和反応の量的関係と中和の公式




水素1molの重さ 質量 や体積はいくら 水素のリットルとグラムの変換方法は 水素1モルのモル質量の計算方法 ウルトラフリーダム




化学基礎 モル 物質量 の計算問題 標準状態の気体の体積 など の解き方 計算力に応じて対応していきましょう 比の使い方 単位を使った解法など 井出進学塾 富士宮教材開発 公式ブログ Note




水の質量と体積を変換 換算 する方法 計算問題を解いてみよう 水の重さの求め方




高校化学基礎 モル体積と気体 練習編 映像授業のtry It トライイット




ボイル シャルルの法則 計算例題 理系ラボ



第93章 理想気体の状態方程式




反応後の値の求め方がわかりません 教えてください Clear




Mol 物質量モル と気体の体積 高校化学 物質量 7 Youtube




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾
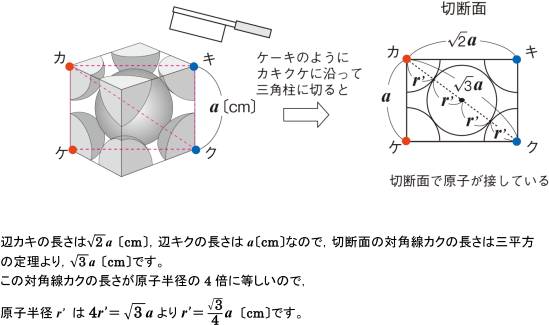



固体の構造と状態変化 単位格子の原子半径の求め方がわかりません 化学 定期テスト対策サイト



Http Honda Sci Yokohama Cu Ac Jp E6 Ba B6 E6 B6 B2 E5 8c 96 E5 Ad A6 2p Pdf



3




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾




物質量の求め方とは 単位や計算問題も解説 高校生向け受験応援メディア 受験のミカタ
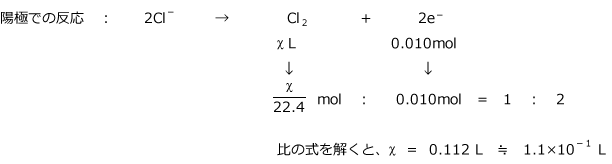



化学講座 第29回 電気分解 ファラデーの法則 私立 国公立大学医学部に入ろう ドットコム




物質量 Mol とモル質量と原子量の関係




センター試験の化学の問題です 解説を見ても分かりませんでした 定期テストに出るので Clear
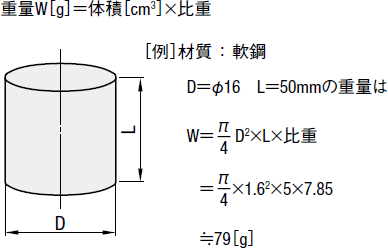



体積 重量の求め方 技術情報 Misumi Vona ミスミ




中学理科 3分でわかる 密度の求め方 出し方の計算公式 Qikeru 学びを楽しくわかりやすく




ボイル シャルルの法則 計算例題 理系ラボ




高校化学 ファラデーの法則と計算 映像授業のtry It トライイット




質量パーセント濃度の求め方とモル濃度の違い
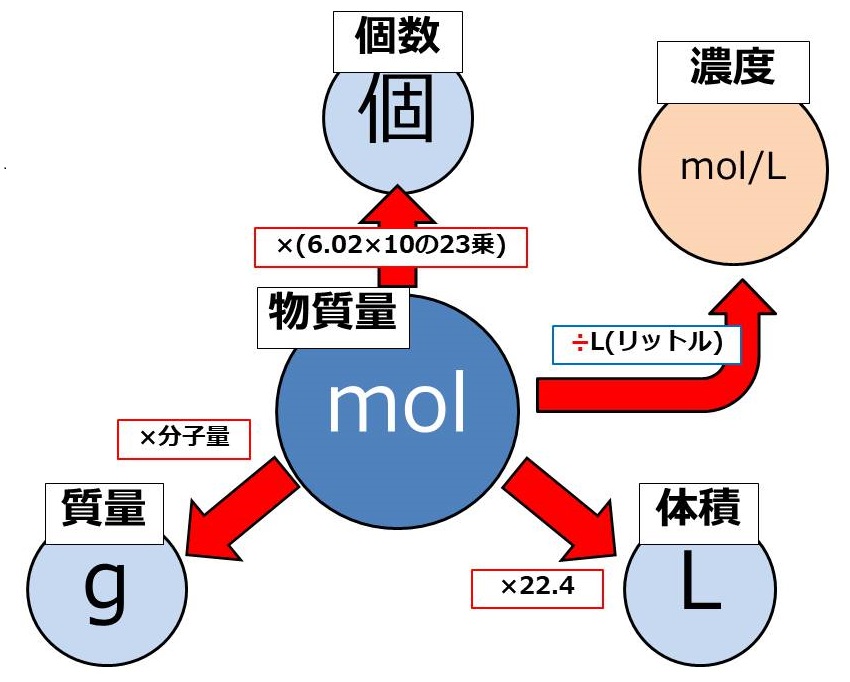



Mol モル の計算と公式 感覚でカンタンに考える化学




高校化学基礎 化学反応式と係数 映像授業のtry It トライイット




5 2 化学反応の量的関係 1 おのれー Note




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




化学反応式 係数 作り方 書き方 計算問題の解き方など 化学のグルメ
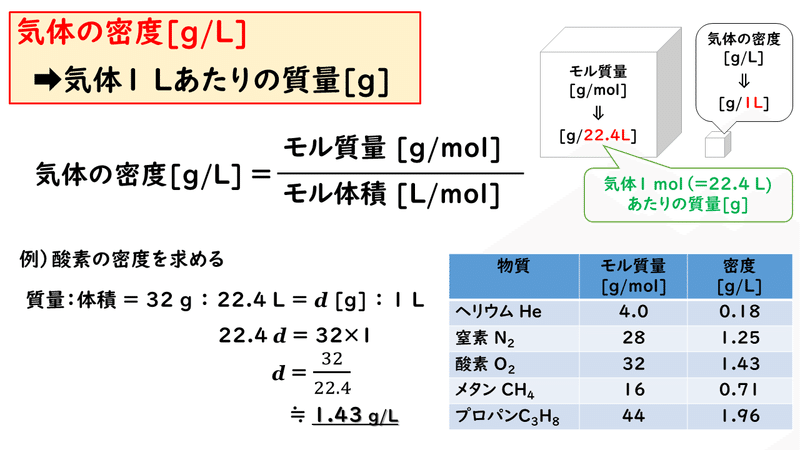



4 5 気体の密度と平均分子量 おのれー Note




高校化学基礎 モル体積とは 映像授業のtry It トライイット



1
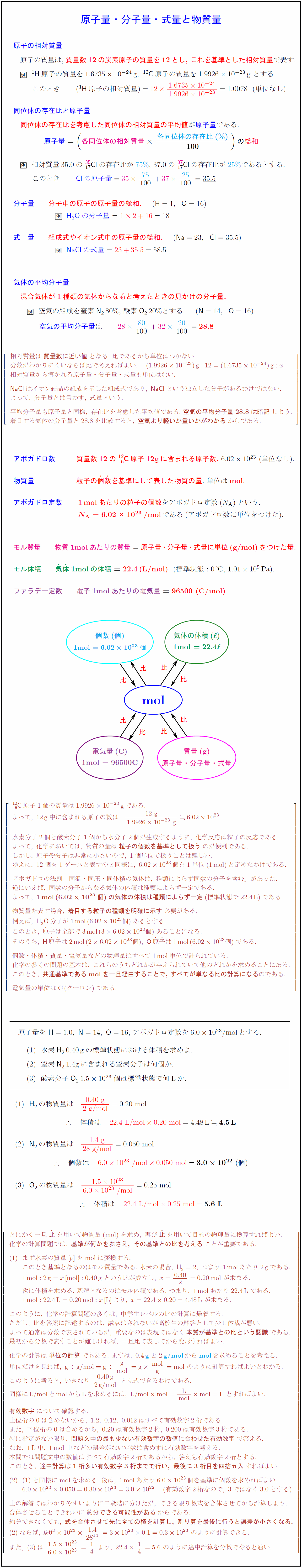



高校理論化学 原子量 分子量 式量と物質量 Mol 化学計算の基本 受験の月




体積の求め方 計算公式一覧



1




化学基礎 物質の変化09 モル体積と気体 10分 Youtube



物質量と気体の体積 化学基礎 高校化学net参考書
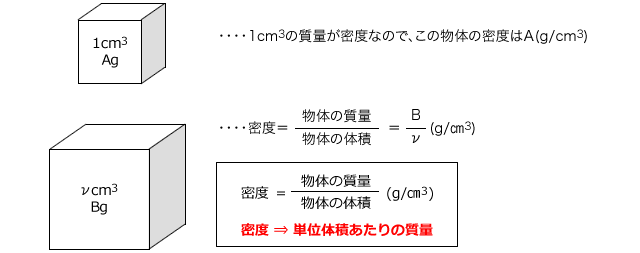



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
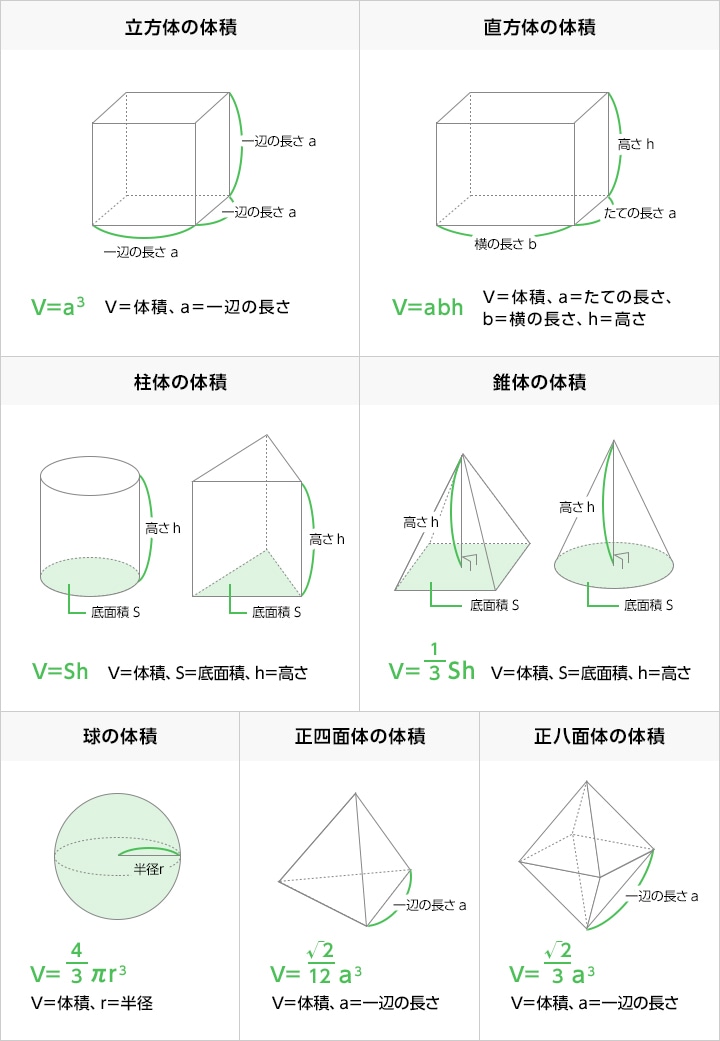



体積の測定 測定のことを 即 知りたい ソクシリ キーエンス



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Body Centered Cubic Lattice
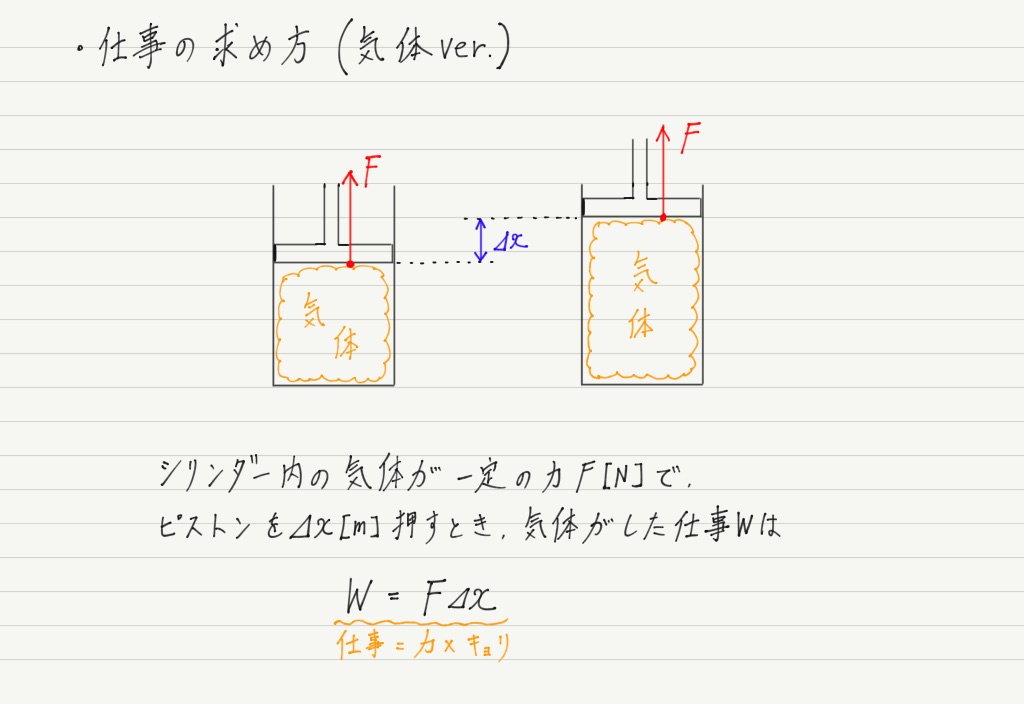



P Vグラフと気体のする仕事 高校物理をあきらめる前に 高校物理をあきらめる前に
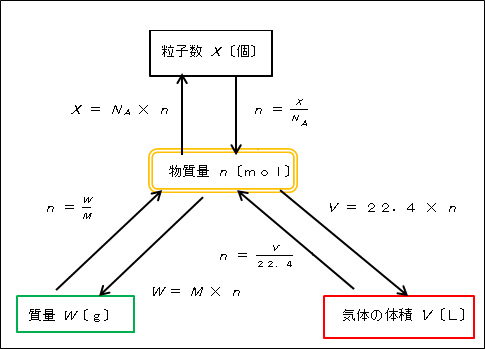



物質量 の指導における イメージ化 化学授業実践記録 アーカイブ一覧 理科 高等学校 知が啓く 教科書の啓林館
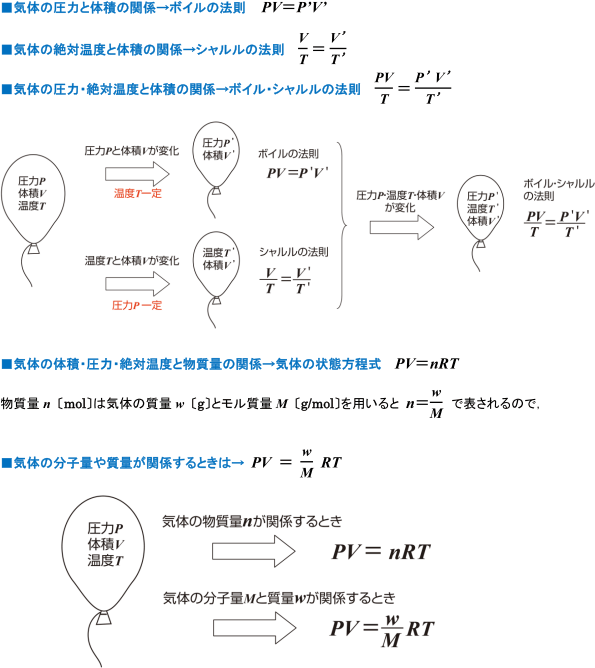



気体の性質 気体の計算の問題で どの式を使えばよいのかわかりません 化学 定期テスト対策サイト
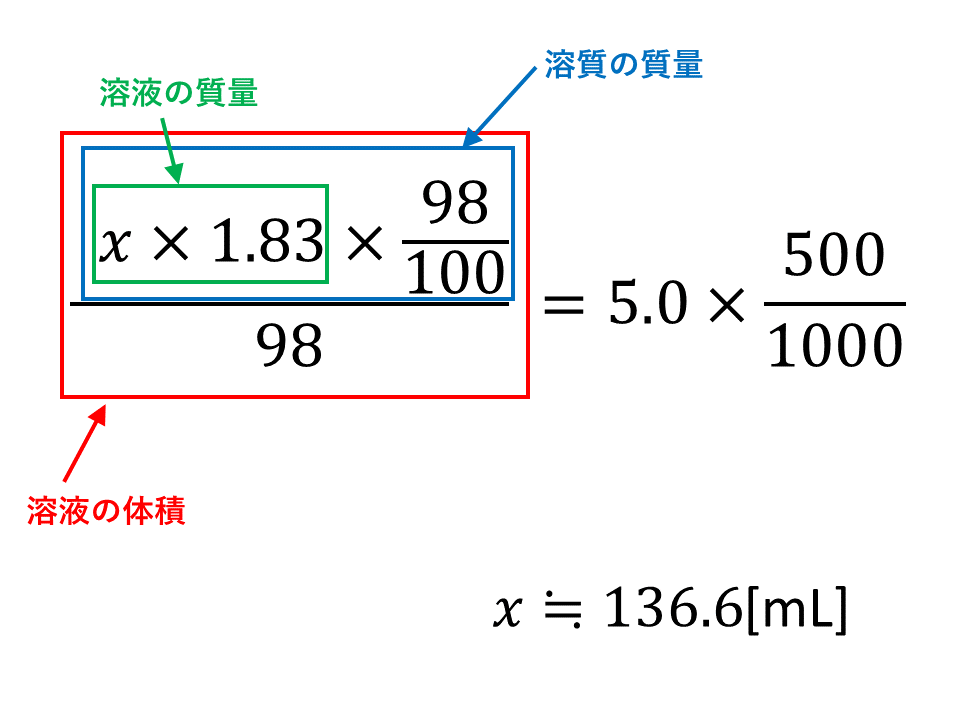



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




Molの基本計算問題 化学がちょっとだけ好きな社労士




密度と比重の違いとは 単位の確認と計算問題の解き方
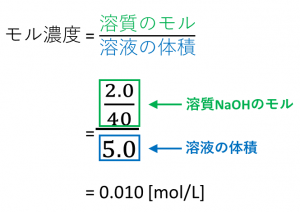



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




体積の求め方 計算公式一覧




反応後の値の求め方がわかりません 教えてください Clear
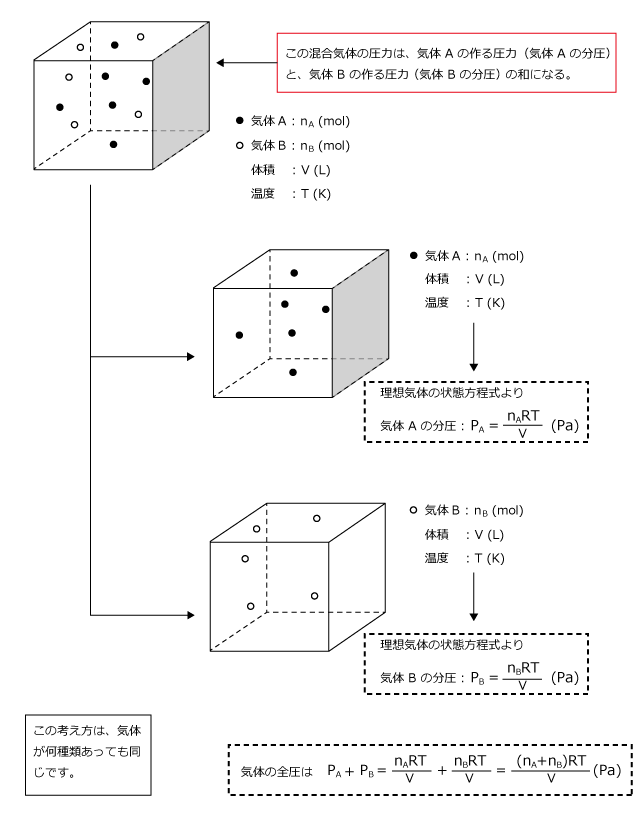



化学講座 第37回 分圧の法則と2気体の混合 私立 国公立大学医学部に入ろう ドットコム




化学基礎です Clear
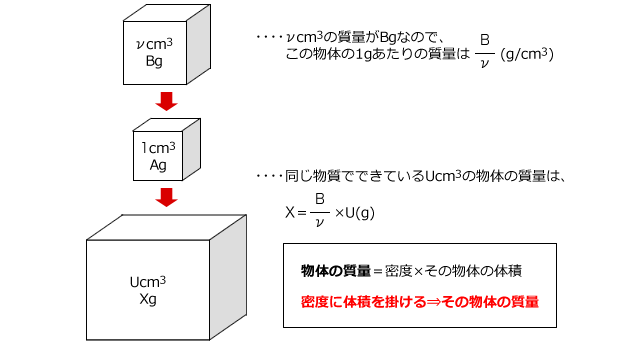



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム




理科 中1 19 密度の計算 Youtube




高校理論化学 気体の溶解度 ヘンリーの法則4パターン 受験の月



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Density Of Diamond



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso 22 4l Mol
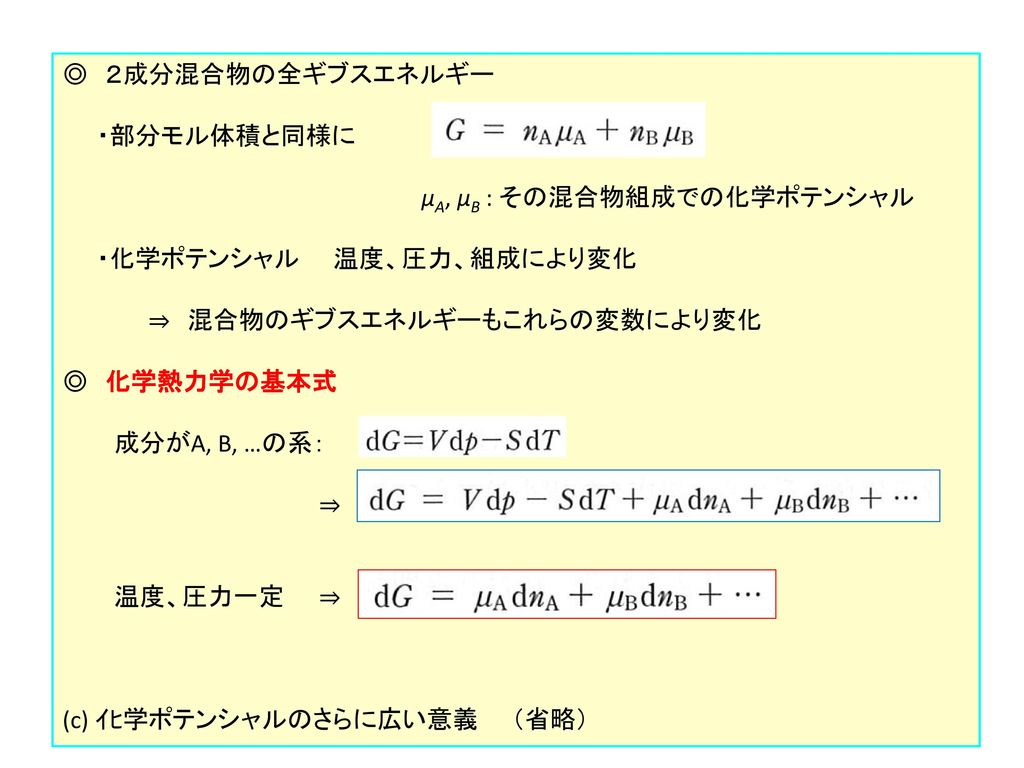



本章 化学ポテンシャルという概念の導入 部分モル量という種類の性質の一つ 混合物の物性を記述するために 化学ポテンシャルがどのように使われるか 基本原理 平衡では ある化学種の化学ポテンシャルはどの相でも同じ 化学 互いに反応できるものも含めて
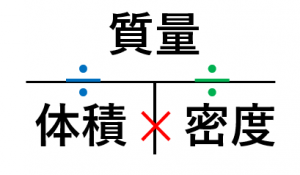



質量 密度 体積それぞれの求め方 具体例で学ぶ数学




化学基礎 気体密度 Youtube




結晶格子 単位格子 の計算問題 アボガドロ定数や密度や原子量の求め方
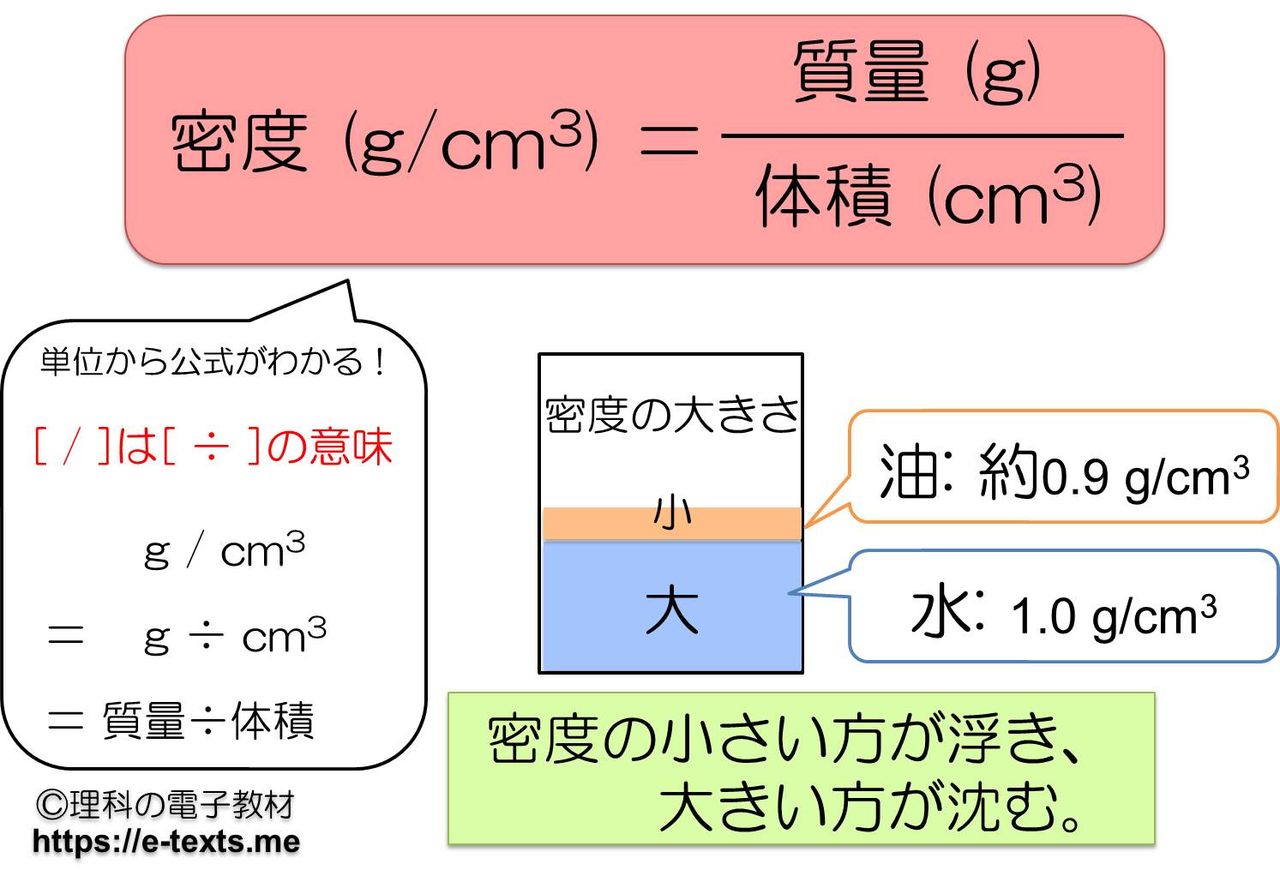



中1化学 密度 Hiromaru Note




この問題の一つ目の モル濃度を求める計算の部分で 1 1 11と 1 1000が何を Clear




化学基礎 基本の物質量 Mol 計算について Study By Tmt




高校化学基礎 モル体積とは 映像授業のtry It トライイット
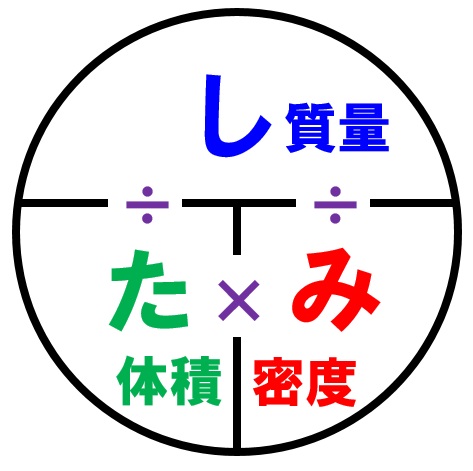



中1理科 密度の求め方3パターンの計算方法 Examee




4 6 溶液の濃度 おのれー Note




固体の構造と状態変化 単位格子から原子量を求める方法がわかりません 化学 定期テスト対策サイト




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾
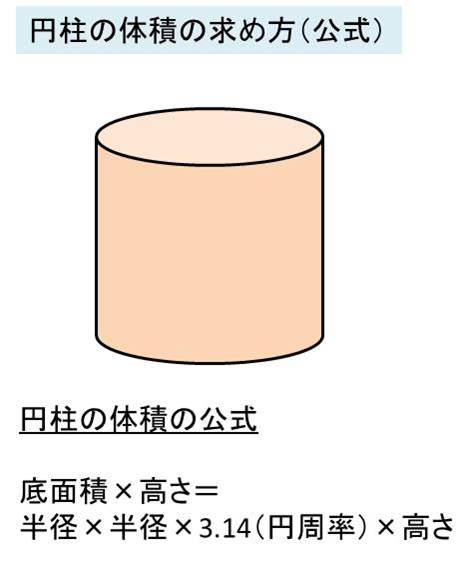



丸棒の重量 円柱の体積と重量の求め方 鉄の場合




高校化学基礎 化学反応式と係数 映像授業のtry It トライイット




化学 水分子1個の質量は Youtube



高校化学の問題です 水で希釈して溶液を精製する問題なのです Yahoo 知恵袋
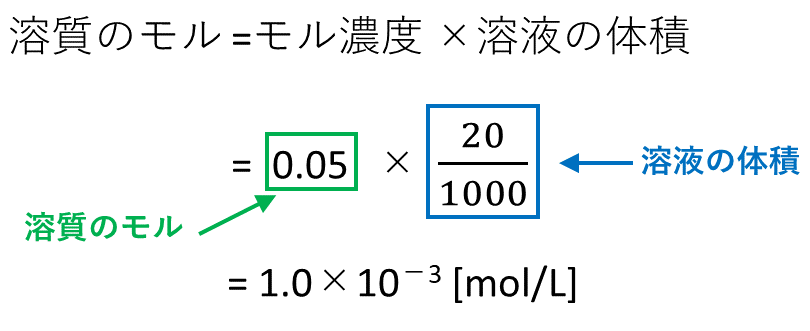



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ
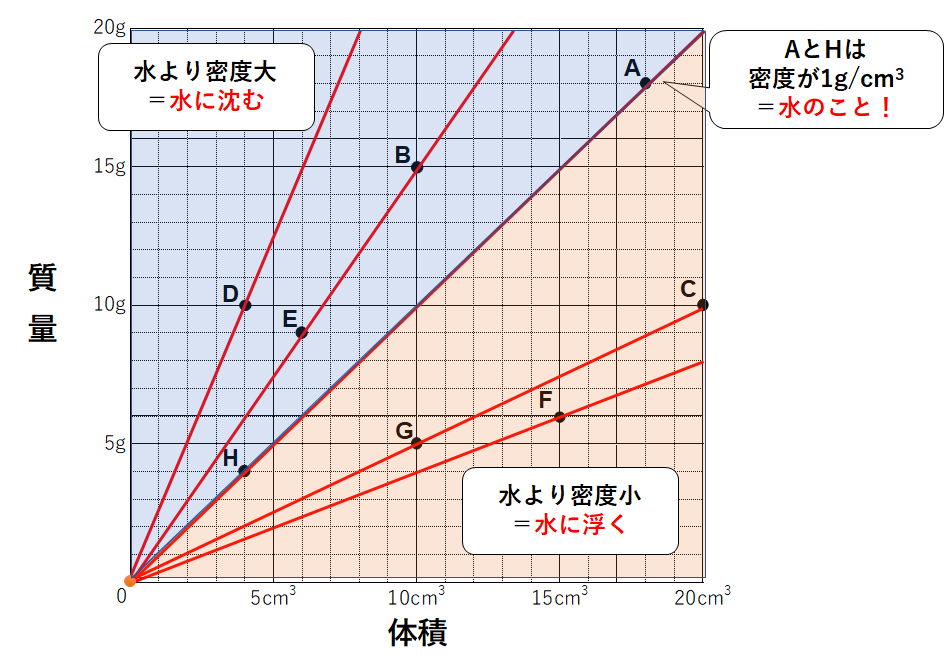



中1化学 密度 中学理科 ポイントまとめと整理




気体の性質 混合気体の反応後の量を求める過程がわかりません 化学 定期テスト対策サイト
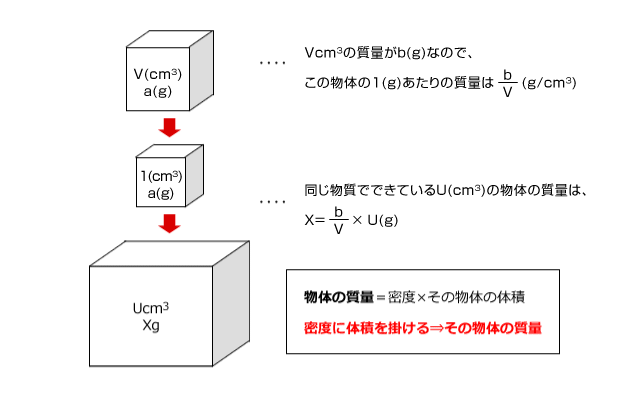



化学講座 第12回 密度と濃度医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム




これでできる モル Mol 計算 化学基礎 最大の難所を突破しよう 化学 アイドル好きのホームページ



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Theory Avogadros Law Calcule
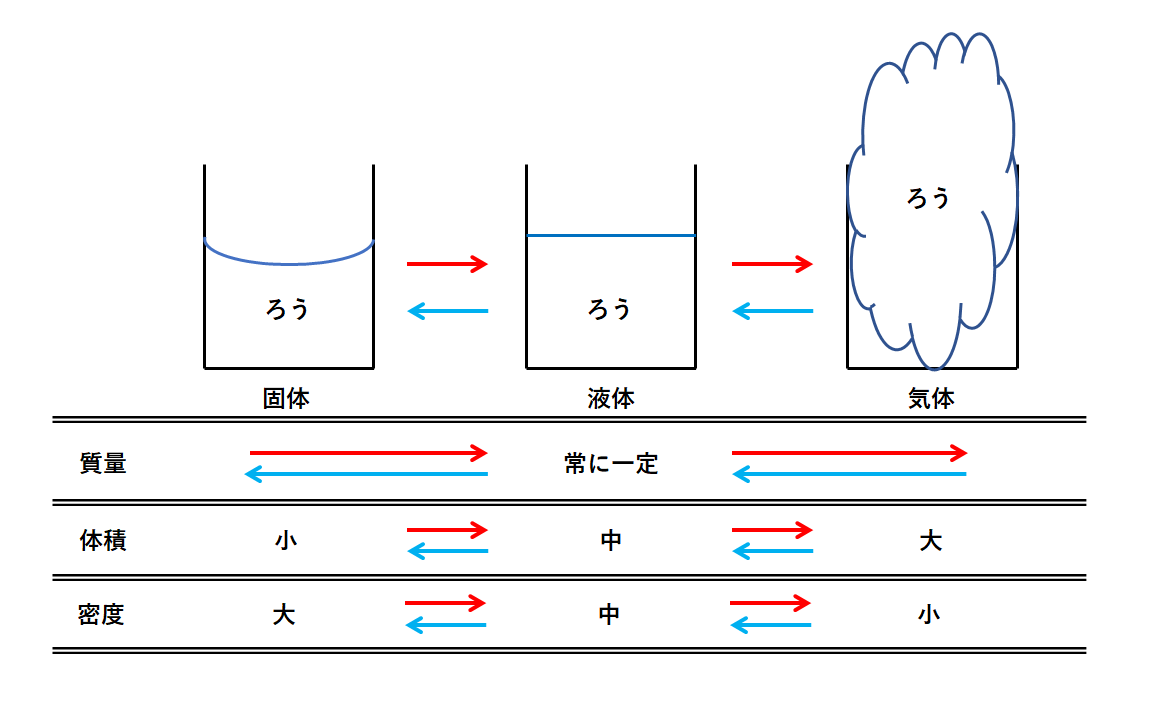



中1化学 状態変化 中学理科 ポイントまとめと整理




部分モル体積についての解説 化学徒の備忘録
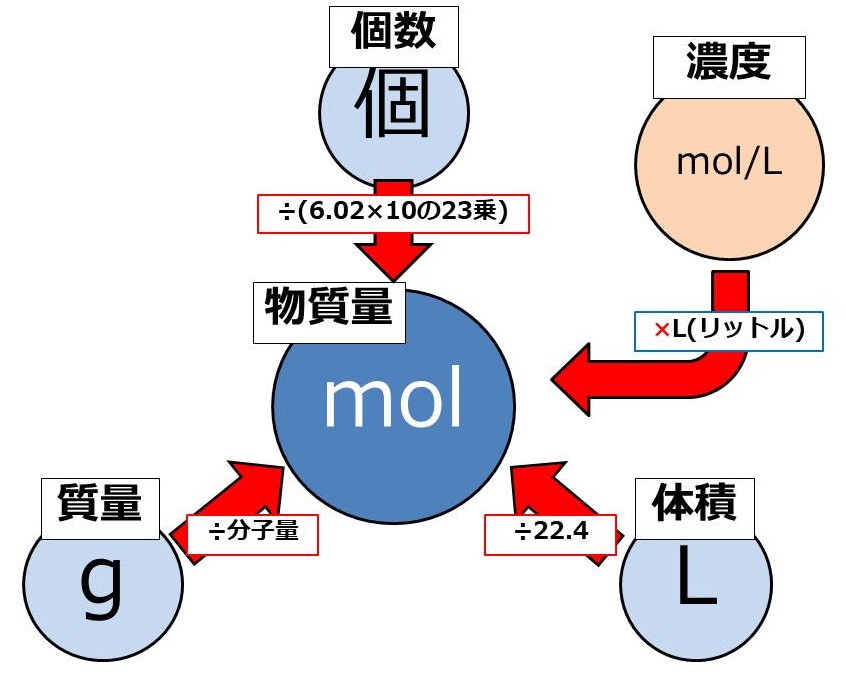



Mol モル の計算と公式 感覚でカンタンに考える化学




高校化学 物質量 伊賀上野 はなまるせんせいの独り言




気体の状態方程式における圧力 体積 気体定数 温度の単位 計算問題をといてみよう




ボイルの法則 気体の体積と圧力の関係




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット



0 件のコメント:
コメントを投稿